
CẬP NHẬT QUY ĐỊNH MỚI LIÊN QUAN ĐẾN GIẤY CHỨNG NHẬN SẢN PHẨM DƯỢC PHẨM
Ngày 05/09/2022, Thứ trưởng Đỗ Xuân Tuyên đã ký ban hành Thông tư 08/2022/TT-BYT thay thế Thông tư 32/2018/TT-BYT quy định về việc đăng ký

Ngày 05/09/2022, Thứ trưởng Đỗ Xuân Tuyên đã ký ban hành Thông tư 08/2022/TT-BYT thay thế Thông tư 32/2018/TT-BYT quy định về việc đăng ký

Tương đương sinh học là gì? Hai chế phẩm thuốc chứa cùng một dược chất được coi là tương đương sinh học nếu hai chế

Thông thường giấy đăng ký lưu hành thuốc có thời hạn hiệu lực là 5 năm, trừ một số trường hợp sau đây có thời

Các cơ sở dữ liệu của các “cơ quan quản lý tham chiếu” đối với Việt Nam được quy định trong Thông tư số 32/2018/TT-BYT
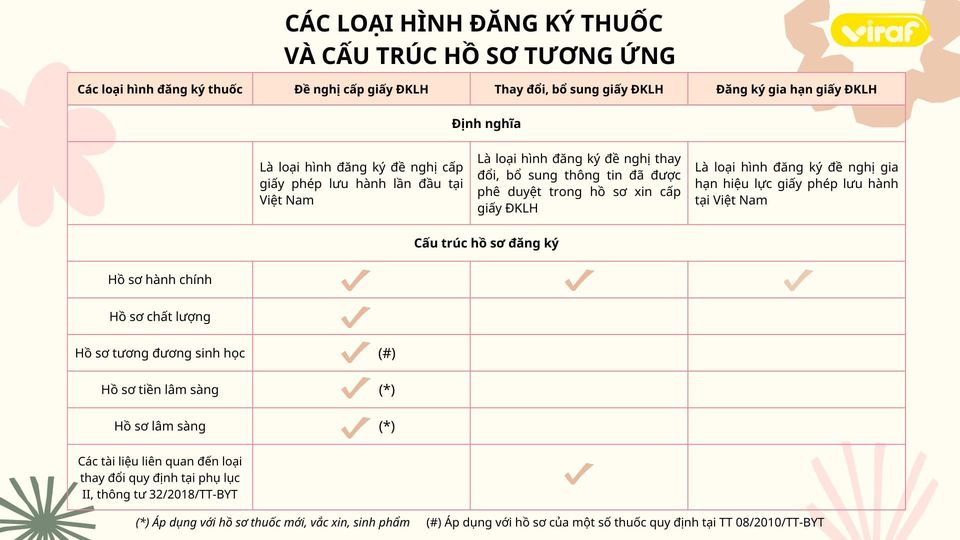
Dưới đây, VIRAF sẽ cập nhật các loại hình đăng ký thuốc và cấu trúc hồ sơ tương ứng
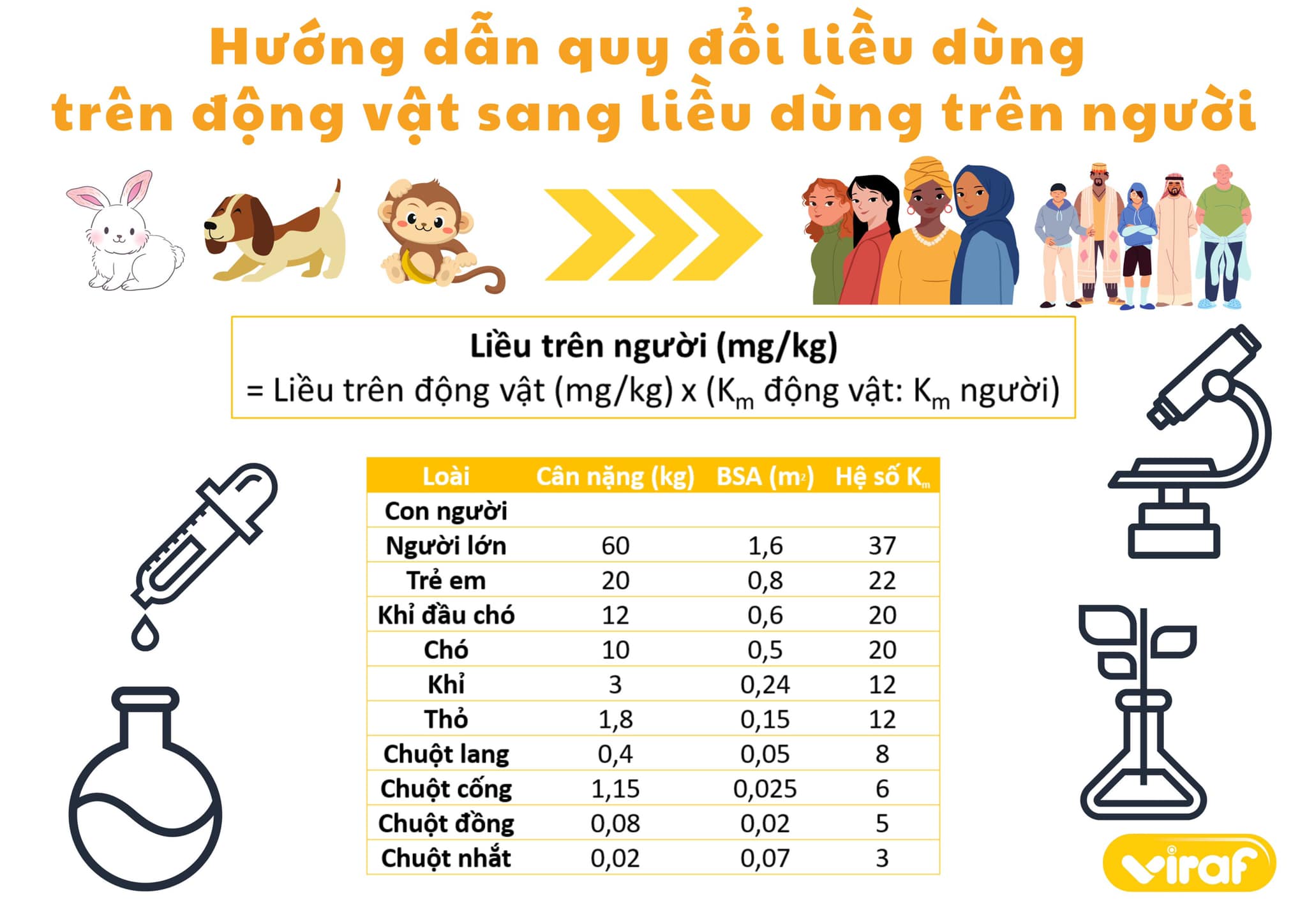
Tìm kiếm tài liệu chứng minh (TLCM) cho các thành phần tạo nên công dụng của sản phẩm luôn được coi là một trong những

Như nội dung Viraf đã chia sẻ từ bài viết ‘Dược điển sử dụng trong đăng ký thuốc’ thì Dược điển được xem là một

Để xác định được cấu trúc bộ hồ sơ cần nộp, trước hết chuyên viên đăng ký thuốc cần xác định được loại hình đăng

Một trong những tài liệu quan trọng cần có của 1 chuyên viên Đăng ký thuốc là Dược điển, bởi đây là cơ sở giúp

Tự học đăng ký cùng Viraf
Công bố sản phẩm Viraf
Copyright © Viraf 2024. All rights reserved.